L’Europa fa marcia indietro e raccomanda di approvare il controverso lecanemab contro l’Alzheimer | Scienza
Un comitato di esperti dell’Agenzia europea per i medicinali ha raccomandato giovedì l’approvazione del lecanemab, il primo farmaco che ha dimostrato di avere qualche effetto contro l’Alzheimer da decenni, ma che è controverso a causa dei suoi effetti collaterali e del prezzo elevato.
L’agenzia ha riunito di nuovo i suoi esperti dopo che i produttori del farmaco hanno fatto appello alla loro decisione iniziale di respingere il farmaco, rilasciato in estate. Nella sua nuova risoluzione, il Comitato di esperti sui medicinali per uso umano ha raccomandato l’uso di questo farmaco, ma limitato ai pazienti che non hanno alcuna copia del gene APOE4 o ne hanno soltanto una. In questo modo si escludono i pazienti con due copie di questo gene (circa il 15% del totale), che sembra essere strettamente correlato all’infiammazione e al sanguinamento che il farmaco può causare. L’EMA solitamente segue le raccomandazioni del suo comitato, quindi sarà probabilmente approvato per l’uso in tutta l’Unione Europea.
È stato dimostrato che il lecanemab, con il nome commerciale Leqembi, ritarda la progressione della malattia del 27%, secondo i risultati di uno studio clinico con 1.700 pazienti in diversi paesi, inclusa la Spagna, per un anno e mezzo. La grande domanda è se questi effetti modesti si traducano in miglioramenti reali per i pazienti e i loro caregiver. Durante lo studio, il farmaco ha causato gonfiore al cervello nel 12% dei pazienti che lo hanno assunto e due di loro sono morti per emorragie cerebrali correlate al farmaco.
Le due aziende che hanno sviluppato Leqembi, la giapponese Eisai e l’americana Biogen, hanno presentato ulteriori dati provenienti dal follow-up dei pazienti per tre anni che dimostrano che il miglioramento cognitivo si mantiene se il trattamento viene continuato, e che sarebbe proprio sulla buona strada soglia di rilevanza clinica. Inoltre, dicono, non ci sono stati altri decessi. Ma questi dati non sono ancora stati esaminati da esperti indipendenti o pubblicati su una rivista scientifica.
Con questa decisione l’Europa si unisce al resto dei Paesi che hanno deciso di approvare il farmaco, tra cui Stati Uniti, Cina, Giappone, Israele, Corea del Sud ed Emirati Arabi Uniti. Anche il Regno Unito ne ha approvato l’utilizzo, ma il suo sistema sanitario pubblico non lo finanzierà, considerando che i suoi effetti sono troppo modesti per il suo costo, circa 24.000 euro all’anno per paziente.
L’Alzheimer è la principale causa di demenza e colpisce circa 50 milioni di persone in tutto il mondo. L’invecchiamento della popolazione minaccia che queste cifre si moltiplichino prima della metà del secolo.
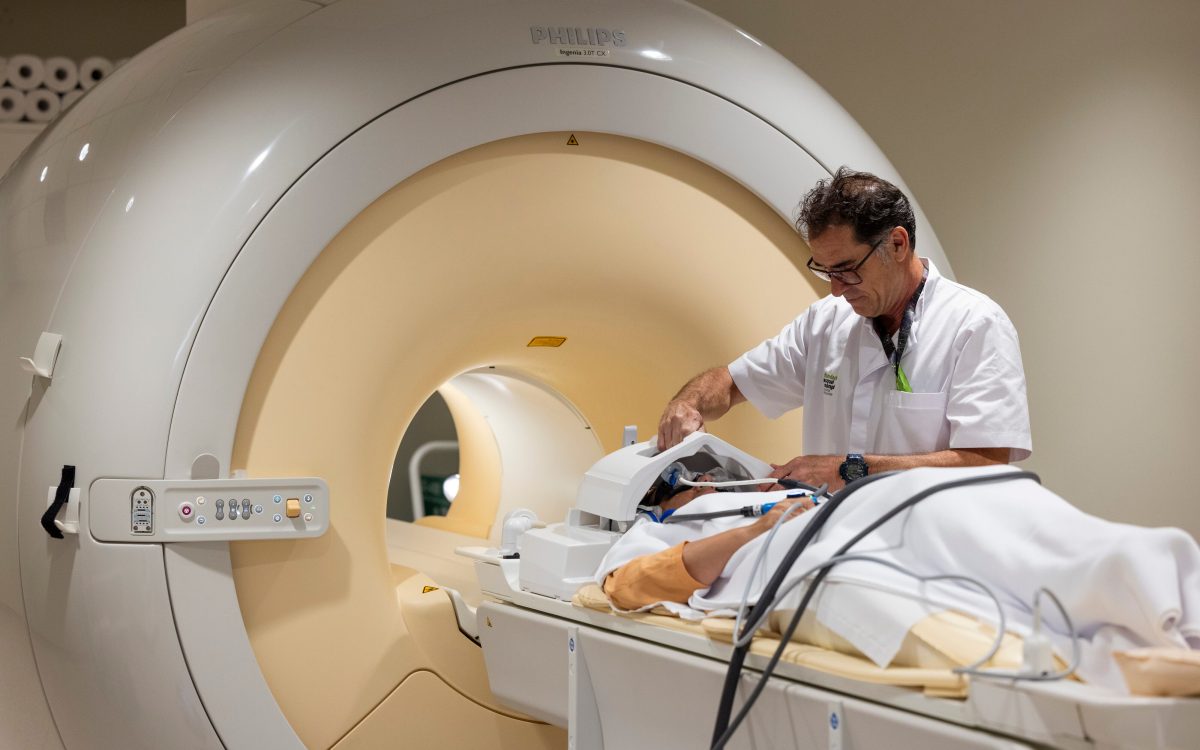
Nonostante le aspettative generate, il lecanemab gioverebbe solo al 5% delle 800.000 persone che vivono con l’Alzheimer nel nostro Paese, secondo le stime della Società Spagnola di Neurologia. Questo farmaco è un anticorpo monoclonale che elimina le placche di proteina amiloide dal cervello, uno dei teorici colpevoli della malattia. Per essere efficace, deve essere somministrato ai pazienti in fasi molto precoci, quando hanno ancora l’indipendenza per vivere da soli, ma iniziano a soffrire di piccoli vuoti di memoria, come dimenticare appuntamenti o ripetere frasi più volte.
Oltre al prezzo, il farmaco presenta enormi sfide per i sistemi sanitari, poiché richiede test diagnostici ospedalieri per misurare la quantità di amiloide, iniezioni endovenose ogni 15 giorni, somministrate anche in ospedale, e diverse scansioni cerebrali per garantire che non vi siano infiammazione del cervello che può causare seri problemi di salute. Il costo totale per paziente all’anno potrebbe aggirarsi sui 40.000 euro, spiega Linus Jönsson, medico ed esperto di economia sanitaria presso il Karolinska Institute in Svezia. Inoltre, trattandosi di una malattia cronica, la cura dovrebbe essere somministrata per tutta la vita.
Negli Stati Uniti, il lecanemab costa 26.500 dollari all’anno. Il Paese ha approvato il farmaco nel gennaio 2023, ma il suo arrivo ai pazienti è lento a causa dei dubbi sulla sua efficacia, sui costi e sugli effetti collaterali.
Donanemab, un secondo anticorpo simile che riduce la progressione dell’Alzheimer del 35%, è stato approvato anche negli Stati Uniti, ma resta in fase di valutazione in Europa.